Peta Konsep

Peta Konsep
A. WUJUD ZAT
Konsep: Zat adalah sesuatu yang menempati ruang dan memiliki massa.
Apakah benda-benda memerlukan tempat? Misal tersedia air yang berada di dalam gelas. Tuanglah air tersebut ke dalam kaleng. Apakah air menempati kaleng? Ternyata air memerlukan tempat atau wadah. Selanjutnya jika air dalam wadah itu ditimbang ternyata memiliki massa. Demikian halnya dengan udara ternyata juga menempati ruang dan memiliki massa.
Di sekitarmu terdapat benda-benda yang dapat kamu kelompokkan kedalam tiga wujud zat. Beberapa benda seperti besi, kayu, aluminium termasuk zat padat. Air, minyak termasuk zat cair, sedangkan gas elpiji, udara termasuk zat gas. Pada prinsipnya terdapat tiga wujud zat yaitu : zat padat, zat cair dan zat gas.
1. Perubahan Wujud Zat
Selepas kamu melakukan kegiatan olah raga tentu akan merasakan haus. Diantara teman kamu mengajak pergi ke kantin sekolah untuk membeli es teh. Tahukah kamu bagaimana cara membuat es? Ketika air dimasukkan ke dalam freezer akan mengalami perubahan wujud yaitu dari cair menjadi padat. Dapatkah kamu menjelaskan perubahan wujud yang terjadi ketika air dipanaskan kemudian mendidih? Perubahan wujud apa pula yang terjadi pada kapur barus yang dimasukkan pada almari pakaian? Coba kamu temukan jawabannya!
Perubahan wujud zat digolongkan menjadi enam peristiwa sebagai berikut.
a. Membeku
Peristiwa perubahan wujud dari cair menjadi padat. Dalam peristiwa ini zat melepaskan energi panas.
b. Mencair
Peristiwa perubahan wujud zat dari padat menjadi cair. Dalam peristiwa ini zat memerlukan energi panas.
c. Menguap
Peristiwa perubahan wujud dari cair menjadi gas. Dalam peristiwa ini zat memerlukan energi panas.
d. Mengembun
Peristiwa perubahan wujud dari gas menjadi cair. Dalam peristiwa ini zat melepaskan energi panas.
e. Menyublim
Peristiwa perubahan wujud dari padat menjadi gas. Dalam peristiwa ini zat memerlukan energi panas.
f. Mengkristal
Peristiwa perubahan wujud dari gas menjadi padat. Dalam peristiwa ini zat melepaskan energi panas.

Skema Perubahan Wujud Zat
B. TEORI PARTIKEL ZAT
Konsep: Molekul adalah bagian terkecil suatu zat yang masih memiliki sifat zat itu. Atom adalah partikel yang sangat kecil penyusun suatu benda.
Zat tersusun atas partikel-partikel yang sangat kecil. Partikel-partikel itu yang dinamakan molekul. Mengapa zat mempunyai bentuk tetap? Mengapa zat cair mempunyai bentuk yang berubah-ubah sesuai dengan wadahnya? Bagaimana bentuk zat gas? Untuk lebih jelasnya ikuti penjelasan berikut ini.
1. Partikel Zat dapat Bergerak
Ternyata saat minyak wangi belum disemprotkan kamu tidak akan mencium aroma minyak wangi itu. Tetapi setelah disemprotkan kamu dapat mencium aroma minyak wangi itu. Hal ini membuktikan sekaligus menunjukkan bahwa zat gas memiliki jarak antarpartikel lebih jauh dan bergerak bebas.
2. Susunan dan Gerak Partikel Pada Berbagai Wujud Zat
a. zat padat

Susunan Partikel Zat Padat
Zat padat mempunyai sifat bentuk dan volumenya tetap. Bentuknya tetap dikarenakan partikel-partikel pada zat padat saling berdekatan, tersusun teratur dan mempunyai gaya tarik antar partikel sangat kuat. Volumenya tetap dikarenakan partikel pada zat padat dapat bergerak dan berputar pada kedudukannya saja.
b. zat cair

Susunan Partikel Zat Cair
Zat cair mempunyai sifat bentuk berubah-ubah dan volumenya tetap. Bentuknya berubah-ubah dikarenakan partikel-partikel pada zat cair berdekatan tetapi renggang, tersusun teratur, gaya tarik antar partikel agak lemah. Volumenya tetap dikarenakan partikel pada zat cair mudah berpindah tetapi tidak dapat meninggalkan kelompoknya.
c. zat gas

Susunan Partikel Zat Gas
Zat gas mempunyai sifat bentuk berubah-ubah dan volume berubah-ubah. Bentuknya berubah-ubah dikarenakan partikel-partikel pada zat gas berjauhan, tersusun tidak teratur, gaya tarik antar partikel sangat lemah. Volumenya berubah-ubah dikarenakan partikel pada zat gas dapat bergerak bebas meninggalkan kelompoknya.
3. Menjelaskan Perubahan Wujud Zat Berdasarkan Teori Partikel
Saat zat padat dipanaskan, mengakibatkan partikel-partikel zat padat bergerak lebih cepat dan gaya tarik antarpartikel menjadi lemah. Akibatnya partikel-partikel dapat berpindah tempat menyebabkan wujud zat berubah dari padat menjadi cair. Bila zat cair dipanaskan, mengakibatkan partikel-partikel zat cair bergerak cepat dan gaya tarik antarpartikel menjadi lemah. Akibatnya partikel-partikel dapat berpindah tempat menyebabkan wujud zat berubah dari cair menjadi gas.
C. KOHESI DAN ADHESI
Konsep: Kohesi adalah gaya tarik menarik antar partikel zat sejenis. Adhesi adalah gaya tarik menarik antar partikel yang tidak sejenis. Cembung dan cekungnya permukaan zat cair dalam tabung disebut meniskus.
Teteskan air raksa di atas permukaan kaca, bagaimana bentuk raksa itu? Ternyata setetes air raksa itu berbentuk bola dan tidak membasahi permukaan kaca. Mengapa dapat terjadi? Karena kohesi air raksa lebih besar daripada adhesi air raksa dengan permukaan kaca. Teteskan air di atas permukaan kaca, bagaimana bentuk air itu? Ternyata setetes air itu menyebar dan membasahi permukaan kaca. Mengapa dapat terjadi? Karena kohesi air lebih kecil daripada adhesi air dengan permukaan kaca.
D. Kapilaritas
Gaya kohesi dan gaya adhesi berpengaruh pada gejala kapilaritas. Kapilaritas adalah gejala naik atau turunnya cairan di dalam pipa kapiler atau pipa kecil. Sebuah pipa kapiler kaca bila dicelupkan pada tabung berisi air akan dijumpai air dapat naik ke dalam pembuluh kaca pipa kapiler, sebaliknya bila pembuluh pipa kapiler dicelupkan pada tabung berisi air raksa akan dijumpai bahwa raksa di dalam pembuluh kaca pipa kapiler lebih rendah permukaannya dibandingkan permukaan raksa dalam tabung. Jadi, kapilaritas sangat tergantung pada kohesi dan adhesi. Air naik dalam pembuluh pipa kapiler dikarenakan adhesi sedangkan raksa turun dalam pembuluh pipa kapiler dikarenakan kohesi.

Peristiwa Kapilaritas
Sekarang banyak dikembangkan teknologi yang mendasarkan pada gaya adhesi maupun kohesi. Beberapa tekstil kain tiruan menghasilkan kain yang kohesif terhadap debu. Jadi, pakaian dari bahan tersebut tidak mudah kotor. Di lain pihak, banyak ditemukan bahan-bahan adhesif serbaguna, lem alteco, dan sejenisnya sangat berguna bagi kehidupan. Bahkan, luka bekas operasi sekarang tidak perlu dijahit melainkan cukup dilem dengan lem khusus yang adhesif dengan jaringan kulit dan otot.
Beberapa contoh gejala kapilaritas yang berkaitan dengan peristiwa alam yaitu:
1. peristiwa naiknya air dari ujung akar ke daun pada tumbuhtumbuhan;
2. naiknya minyak tanah pada sumbu kompor;
3. basahnya tembok rumah bagian dalam ketika hujan. Ketika terkena hujan, tembok bagian luar akan basah, kemudian merembes ke bagian yang lebih dalam.
D. MASSA JENIS
Untuk menentukan massa jenis suatu zat dapat dilakukan dengan melakukan membagi massa zat dengan volume zat. Jika massa jenis zat (baca rho), massa zat m dan volume zat V maka diperoleh persamaan:

Rumus Massa Jenis
Keterangan:
= massa jenis zat (Kg/m3)
m = massa zat (kg)
V = volume zat (m3)
Perbandingan antara massa zat dengan volume zat disebut massa jenis. Massa jenis menunjukkan kerapatan suatu zat.
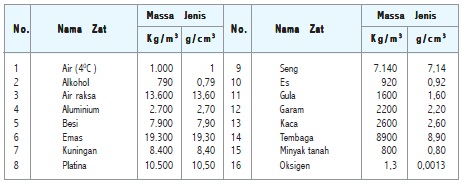
Massa Jenis Beberapa Zat
Berikut beberapa hal tentang massa jenis suatu zat.
1. Satuan Massa Jenis
Satuan massa jenis dalam SI adalah kg/m3 yang dapat pula dikonversikan ke satuan yang lain misalnya g/cm3.
2. Menentukan Massa Jenis Zat Padat
a. Bentuknya teratur
Langkah yang harus dilakukan adalah mengukur massa zat dengan menggunakan neraca atau timbangan. Volume zat dapat dihitung menggunakan rumus berdasarkan bentuknya misalnya, kubus, balok. Langkah terakhir menentukan massa jenis zat dengan membagi massa zat dengan volume zat.
b. Bentuknya tidak teratur
Misalnya yang hendak kamu ketahui adalah massa jenis batu. Langkah yang harus kamu lakukan sebagai berikut :
1) Timbanglah batu dengan menggunakan neraca untuk mengetahui massa batu. Catat hasil pengukuranmu!
2) Sediakan gelas ukur dan tuangkan air ke dalam gelas ukur tersebut. Catat volumenya, misal V1 = 50 ml.
3) Masukkan batu yang hendak kamu ketahui volumenya ke dalam gelas ukur yang berisi air. Catat kenaikan volume airnya, misalnya V2 = 70 ml.
4) Volume batu = V2 – V1
5) Massa jenis zat merupakan hasil bagi massa zat dengan volume zat.
3. Menentukan Massa Jenis Zat Cair
Massa jenis zat cair dapat diukur langsung dengan menggunakan hidrometer. Hidrometer memiliki skala massa jenis dan pemberat yang dapat mengakibatkan posisi hidrometer vertikal. Cara mengetahui massa jenis zat cair adalah dengan memasukkan hidrometer ke dalam zat cair tersebut. Hasil pengukuran dapat diperoleh dengan acuan semakin dalam hidrometer tercelup, menyatakan massa jenis zat cair yang diukur semakin kecil.
4. Massa Jenis Zat Berguna untuk Menentukan Jenis Zat
Pernahkah kamu menjumpai suatu zat yang tidak dapat disebutkan jenisnya? Kamu dapat menentukan jenis suatu zat dengan cara mengukur massa zat dan volumenya, selanjutnya mencari massa jenis zat tersebut dengan cara membagi massa zat dengan volume zat. Hasil yang diperoleh dikonfirmasikan dalam tabel massa jenis berbagai zat.
5. Manfaat Mengetahui Massa Jenis
Mengapa aluminium digunakan untuk bahan pembuatan pesawat terbang? Mengapa polystyrene digunakan sebagai bahan mebeleir? Tahukah kamu alasannya? Aluminium bersifat kuat dan memiliki massa yang kecil sehingga ringan tidak seperti logam-logam lainnya misalnya, besi. Polystyrene memiliki massa yang cukup rendah dan massa jenis rendah. Hal ini mengandung makna polystyrene digunakan sebagai bahan mebeleir yang menempati ruangan luas tetapi massanya cukup rendah.
Penggunaan Konsep Massa Jenis dalam Kehidupan Sehari-Hari
1. Kapal Selam
Tahukah kamu mengapa es dapat terapung di air, sedangkan batu tenggelam dalam air? Es memiliki massa jenis lebih kecil dari air, sehingga es dapat terapung dalam air. Batu tenggelam dalam air karena memiliki massa jenis lebih besar daripada air. Tahukah kamu mengapa kapal selam dapat terapung dan tenggelam di air? Ketika terapung massa jenis total kapal selam lebih kecil dari air laut dan sewaktu tenggelam massa jenis total kapal selam lebih besar dari air laut. Kapal selam memiliki tangki pemberat yang berisi air dan udara. Tangki tersebut terletak di antara lambung kapal sebelah dalam dan luar. Tangki dapat berfungsi membesar atau memperkecil massa jenis total kapal selam. Ketika air laut dipompa masuk ke dalam tangki pemberat, massa jenis kapal selam lebih besar dan sebaliknya agar massa jenis total kapal selam menjadi kecil, air laut dipompa keluar.
2. Balon Gas
Pernahkah kamu melihat balon udara? Tahukah kamu, gas apa yang terdapat di dalamnya? Balon gas berisi gas helium. Gas helium memiliki massa jenis yang lebih kecil dari udara, sehingga balon gas bisa naik ke atas.
3. Air Minum Dingin di Dalam Lemari Es
Suatu ketika kamu mungkin pernah melihat dalam botol air minum dingin yang berasal dari lemari es terdapat endapan kapur. Kenapa hal itu dapat terjadi? Air yang jernih dapat juga mengandung kapur, namun apabila dilihat langsung dengan mata tidak kelihatan. Ketika air dingin massa jenis air lebih kecil dan terpisah dari kapur sehingga kapur yang memiliki massa jenis lebih besar akan turun ke bawah dan mengendap.
REFERENSI:
Any Winarsih, dkk. 2008. IPA Terpadu untuk SMP/ MTS Kelas VII. Jakarta: Pusat Perbukuan Departemen Pendidikan Nasional
Teguh Sugiyarto. 2008. Ilmu Pengetahuan Alam 1 untuk SMP/ MTs Kelas VII. Jakarta: Pusat Perbukuan Departemen Pendidikan Nasional.
Sumber :
https://unitedscience.wordpress.com/ipa-1/bab-4-konsep-zat-dan-wujudnya/




 or
or 
 kita mendapatkan:
kita mendapatkan: kita mendapatkan:
kita mendapatkan: